Tác dụng của chuối hột với tiểu đường (thí nghiệm)

Giới thiệu luận văn "Nghiên cứu khả năng hạ đường huyết của cây chuối hột Musra barjoo Sieb lên chuột gây tiểu đường type 2".
Bài viết chỉ trích một số đoạn của luận văn, chi tiết luận văn xin vui lòng liên hệ tác giả Nguyễn Thị Duyên.
Giới thiệu cây chuối hột
Chuối hột (Musra barjoo Sieb) là loài cây có mặt ở nhiều nơi trên đất nước ta. Nhân dân ta đã theo kinh nghiệm dân gian để chữa một số bệnh như: hắc lào, đau răng, sỏi thận, trĩ, mụn nhọt, tiêu chảy, ĐTĐ, … bằng các bộ phận khác nhau của cây.
Để góp phần làm sáng tỏ hơn tác dụng điều trị ĐTĐ của cây chuối hột, chúng tôi tiến hành đề tài “Nghiên cứu khả năng hạ đường huyết của cây chuối hột Musra barjoo Sieb lên chuột gây tiểu đường type 2” với mục tiêu:
- Nghiên cứu ảnh hưởng của dịch chiết các phân đoạn quả và củ chuối hột trên mô hình chuột gây ĐTĐ type 2.
- Phân lập và xác định cấu trúc một số hợp chất hóa học có trong dịch chiết các bộ phận cây chuối hột.
Chuối hột (còn gọi chuối hạt, chuối chát) có tên khoa học là: Musra barjoo Sieb, hay Musa brachycarpa, Musa seminifera Musaceae (họ Chuối -Musaceae) [7, 8, 9].

1.2.1. Đặc điểm thực vật và phân bố
Chuối hột thuộc lớp thực vật một lá mầm. Cây thân giả, cao 2-4m, to, màu xanh. Lá to có phiến dài, xanh hơi mốc mốc, bẹ xanh. Buồng hoa nằm ngang, mo đỏ sẫm, không quấn lên, có phác hoa dạng ghé tạo thành buồng chuối ở tận ngọn, có nhiều hoa trong một buồng, hoa sắp thành hai hàng tạo thành nải chuối. Các hoa đực nằm ở nải trên ngọn (ngọn của buồng), còn ở phần gần cọng của phác hoa (gốc của buồng) là hoa lưỡng tính. Quả có cạnh, thịt quả nạc chứa nhiều hạt to 4-5mm. Mỗi quả chứa trung bình 15-25 hạt. Bộ phận thường dùng là củ, quả, thân. Có thể thu hái các bộ phận của cây quanh năm.
Cây mọc hoang hoặc được trồng ở nhiều nơi trên đất nước ta, đặc biệt là vùng rừng núi phía Bắc và các tỉnh miền Trung. Người dân ở đây thường dùng lá để gói bánh, quả để ăn và làm gia vị, thân để nuôi gia súc. Theo kinh nghiệm dân gian, một số người đã sử dụng các bộ phận khác nhau của cây để làm thuốc [7, 8, 9].
1.2.2. Thành phần hóa học của chuối hột
Năm 1987, J.Horry và M.Ray (Pháp) đã nghiên cứu và xác định trong lá bắc của cây có anthocianin. Trong đó, delphinidin và cyanidin là các anthocianidin chính.
Năm 1995, Kong. L & cộng sự (Trung Quốc) đã nghiên cứu phân lập enzyme polyphenol oxydase trong vỏ quả chuối.
Năm 1998, T.Kamo & cộng sự (Nhật Bản) xác định được phytoalexin; 1,2,3,4-tetrahydro-6,7-dihydroxy-1-(4'-hydroxycinnamyliden) naphthalen-2- on; 2-(4'-methoxyphenyl)-1,8-naphthalic anhydrid; 2-phenyl-1,8-naphthalic
anhydrid trong quả.
Năm 1991 M.Ali (Ấn Độ) công bố ba Neo-clerodan Diterpenoid phân lập được từ hạt Musa balbisiana là: musabalbisian A, B, C. Cấu trúc của các thành phần này cũng đã được xác định bằng phương pháp phân tích quang phổ và phương pháp hóa học.
Ở Bộ môn Dược liệu - Khoa Dược, Đại học Y Dược, TP Hồ Chí Minh, Nguyễn Thị Mỹ Hạnh và Bùi Mỹ Linh đã nghiên cứu xác định thành phần hóa học của hạt chuối hột. Kết quả cho thấy, trong hạt chuối hột có các chất: saponin, coumarin, tanin, flavonoid anthocianosid và hợp chất uronic, tinh dầu, phytosterol …
1.2.3. Tác dụng của cây chuối hột
Theo cuốn “450 vị thuốc nam có tên trong bản Dược thảo Trung Quốc” (Nhà xuất bản Y học - 1963) thì tác dụng sinh lý của chuối hột với nhiều phương pháp khác nhau, các phần của cây chuối hột (gồm hạt, quả, củ) được sử dụng để chữa trị rất nhiều loại bệnh:
- Trị đau răng, lợi có mủ: Vỏ hoặc củ chuối hột, da trăn, cam thảo nam đồng lượng đốt toàn tính cùng phèn phi, tán bột, trộn dầu dừa bôi vào chân răng.
- Trị nóng sốt phát cuồng, nói sảng: Thân chuối xẻ đôi, bỏ giun đất vào nướng kĩ, ép lấy nước uống.
- Trị sỏi đường niệu: hạt, quả xanh sắc nước uống; nước trích từ thân cây, uống mỗi sáng một chén, dùng 1-2 tháng.
- Trị chứng viêm loét dạ dày: Chuối hột già thái mỏng, phơi khô, tán bột uống với nước nóng.
- Trị chứng trĩ ra máu: nõn chuối hột nướng nóng chườm vào hậu môn; nõn chuối tiêu, bột khô của trái chuối hột đem giã nát gói vào lá chuối non, nướng cho nóng đắp vào hậu môn.
- Trị mụn nhọt: Khi nhọt đã hình thành, sưng, nóng, đỏ, đau nhức nhiều; củ chuối rửa sạch giã nát với muối rồi đắp lên nhọt mỗi ngày.
- Giải độc thực phẩm: quả xanh thái mỏng, ăn sống cùng với các rau sống khác, trừ được các chất độc trong rau sống hay trong thịt cá.
- Trị bệnh đường ruột: Ăn quả chín, nhai cả hạt trị giun; vỏ quả 4-8g sắc uống trị kiết lị.
- An thai: Củ chuối, rễ móc mỗi thứ 20g sắc uống.
- Chữa sản hậu tê thấp, chân tay tê dại: Hoa chuối thái nhỏ, sao vàng hạ thổ, sắc lấy nước uống, bã đắp vào nơi tê đau.
- Cầm máu: Thân cây giã nát đắp vào vết thương chảy máu.
- Trị ĐTĐ:
+ Uống nước trích từ thân cây chuối hột mỗi sáng.
+ Trái chuối hột già hoặc vừa chín, xát mỏng, phơi khô, sắc uống thay nước trong ngày.
+ Củ chuối giã nát lấy nước uống.
+ Ốc bươu rửa sạch bung với củ chuối ăn chữa bệnh ĐTĐ.
1.3. Một số hợp chất tự nhiên ở thực vật
1.3.1. Saponin
Saponin là một loại glicozid tự nhiên thường gặp trong nhiều loài thực vật. Dưới tác dụng của axit loãng và enzyme trong thực vật, vi khuẩn, saponin bị thủy phân thành các phần gồm genin gọi là sapogenin và phần đường gồm
một hoặc nhiều phân tử đường.
Dựa vào cấu trúc của phần sapogenin, người ta chia saponin ra làm 3 nhóm lớn là triterpenoid saponin, steroid saponin và glicoancaloid dạng steroid.
Tác dụng sinh học: saponin có tác dụng long đờm, chữa ho (viễn chí, cát cánh, cam thảo, thiên môn, mạch môn); saponin có mặt trong các vị thuốc bổ như nhân sâm, tam thất…; saponin làm tăng tính thấm của tế bào, có tác dụng chống viêm, kháng khuẩn, kháng nấm, ức chế vius [18].
1.3.2. Flavonoid
Các flavonoid là lớp chất phổ biến trong thực vật. Chúng là hợp chất được cấu tạo gồm hai vòng benzene A, B được kết nối bởi 1 dị vòng C với khung cacbon C6-C3-C6. Các flavonoid là dẫn xuất của 2-phenol chroman (flavan) [14].
Các flavonoid có ở trong tất cả các bộ phận của cây, bao gồm quả, phấn, hoa, rễ, … Một số flavonoid có hoạt tính sinh học thể hiện ở khả năng chống oxi hóa.
Tác dụng sinh học [18]:
- Flavonoid có khả năng kìm hãm quá trình oxy hóa dây chuyền sinh ra bởi gốc tự do hoạt động. Những flavonoid có các nhóm hydroxyl sắp xếp ở vị trí octo dễ dàng bị oxy hóa dưới tác dụng của các enzyme polyphenoloxydaza tạo thành các semiquinon hoặc quinon. Semiquinon hoặc quinon là những gốc tự do bền vững, chúng có thể nhận điện tử và hydro từ chất cho khác nhau để trở lại dạng hydroquinone. Các chất này có khả năng phản ứng với các gốc tự do hoạt động sinh ra trong quá trình sinh lý và bệnh lý để tiêu diệt chúng.
- Flavonoid có khả năng điều hòa hoạt độ enzyme do khả năng liên kết với nhóm amin trong phân tử protein, làm thay đổi cấu hình không gian của enzyme, do đó tạo hiệu ứng điều hòa dị lập thể.
- Flavonoid có tính kháng khuẩn, kháng virus, tăng khả năng đề kháng của cơ thể do kích thích lympho bào, tăng sản xuất interferon.
- Flavonoid có hoạt tính của vitamin P, làm tăng tính bền và đàn hồi của thành mạch, giảm sức thấm của mao mạch. Flavonoid còn có tác dụng chống ung thư do kìm hãm các enzyme oxy hóa khử, kìm hãm phân bào, phá vỡ cân bằng trong các quá trình trao đổi chất của tế bào ung thư.
- Flavonoid có hoạt tính chống ĐTĐ.
1.3.3. Alkaloid
Alkaloid là hợp chất hữu cơ chứa nitơ, đa số có nhân dị vòng, có tính kiềm, thường gặp ở thực vật và đôi khi cả ở động vật, thường có hoạt tính sinh học mạnh và cho phản ứng hóa học với một số thuốc thử, gọi là thuốc thử chung của alkaloid.
Tác dụng sinh học: Alkaloid được hình thành từ các sản phẩm của quá trình trao đổi chất như protein. Ở trong cây, alkaloid được coi như là chất dự trữ cho qua trình tổng hợp protein, các chất bảo vệ cây, tham gia sự chuyển hóa hydro ở các mức độ khác nhau [14, 18].
1.3.4. Tanin
Tanin là những hợp chất phenol có trọng lượng phân tử cao, có chứa cả nhóm chức hydroxyl và các nhóm chức khác như cacboxyl, có khả năng tạo phức với protein và các phân tử khác trong điều kiện môi trường đặc biệt.
Tanin được cấu tạo dựa trên axit gallic và axit tanic. Tanin có hai nhóm chính là tanin thủy phân và tanin ngưng tụ.
Tác dụng sinh học: Tanin là chất cầm rửa do có tác dụng giảm sự bài tiết trong ống tiêu hóa, kết tủa protein tạo thành một màng che niêm mạc.
Tanin chữa ngộ độc kim loại nặng, chống ung thư. Tanin ở nồng độ cao ức chế hoạt động của các enzyme nhưng ở nồng độ thấp chúng thường kích hoạt enzyme. Tanin còn có tác dụng diệt khuẩn, cầm máu, giảm đau [14, 18].
Chương 2. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng nghiên cứu
2.1.1. Mẫu thực vật
Cây chuối hột được thu hái ở Tân Yên – Bắc Giang vào tháng 10 năm 2009.
2.1.2. Đối tượng động vật
Chuột nhắt trắng chủng Swiss, cân nặng từ 18-22g do Viện Vệ sinh
dịch tễ Trung ương cung cấp.
2.1.3. Hóa chất và thiết bị nghiên cứu
2.1.3.1. Dụng cụ và thiết bị tách chiết
Các dụng cụ và thiết bị dùng cho tách chiết và tinh chế các hợp chất:
- Bình chiết
- Máy cô quay chân không
- Đèn tử ngoại hai bước sóng 254 và 368nm
- Tủ sấy chân không
- Micropipet
- Bình sắc ký loại phân tích và điều chế
- Cột sắc ký pha thường các loại đường kính
- Máy phun dung dịch thuốc thử
- Bếp điện
- Máy đo đường huyết hiệu Onetouch Johnson.
2.1.3.2. Dụng cụ và thiết bị xác định cấu trúc
- Máy phổ cộng hưởng từ hạt nhân NMR AM500 FT-NMR
spectrometer
- Máy sắc ký lỏng cao áp ghép nối khối phổ (ESI) AGILENT 1100 LCMSD Trap spectrometer
- Thiết bị đo điểm nóng chảy Kofler micro-hotstage
- Thiết bị đo độ quay cực JASCO DIP-1000 KUY polarimeter
2.1.3.3. Hóa chất
- STZ (streptozotocin), Sigma. ST. Louse.
- Silica gel 60 (0,04-0,063 mm) Merck.
- Silica gel pha đảo ODS hoặc YMC (30-50 µm, FuJislisa Chemical Ltd.).
- Bản mỏng tráng sẵn pha ngược RP18 F254s (Merck).
- Bản mỏng điều chế pha thường DC-Alufolien 60 F254 (Merck).
- Các loại dung môi hữu cơ như methanol, ethanol, ethylacetat,
chloroform, n-hexan, aceton, … là hoại hóa chất tinh khiết của Merck.
2.2. Phương pháp nghiên cứu
Trong quá trình nghiên cứu, chúng tôi tiến hành nghiên cứu theo hướng sau:

Sơ đồ nghiên cứu
2.2.1. Khảo sát sơ bộ thành phần hóa học của cây chuối hột
2.2.1.1. Thử định tính saponin
Phản ứng tạo bọt [14, 18]:
Để phát hiện nhanh chóng các saponin người ta thường dựa vào tính tạo bọt của chúng. Các saponin steroid thường tạo bọt bền vững trong môi trường kiềm, còn các saponin triterpenoid lại tạo bọt bền vững trong môi trường axit. Dựa vào điều này người ta có thể phát hiện sơ bộ 2 loại saponin steroid và triterpenoid.
Pha mẫu thử trong ethanol với một lượng thích hợp. Lấy 2 ống nghiệm:
Ống 1: 5ml dung dịch NaOH 0,5N (pH = 13).
Ống 2: 5ml dung dịch HCl 0,1N (pH = 1).
Cho vào mỗi ống 5ml dịch chiết mẫu thử, lắc mạnh 2 ống, nếu thấy có
nhiều bọt và bền vững trong môi trường kiềm là có mặt của saponin steroid,
nếu thấy nhiều bọt và bền vững trong môi trường axit là saponin triterpenoid.
2.2.1.2. Thử định tính Flavonoid
+ Phản ứng Shinoda:
Cho dung dịch mẫu vào 2 ống nghiệm:
Ống 1: Dùng làm đối chứng.
Ống 2: Nhỏ từ từ vài giọt HCl, thêm một chút bột Mg vào, để 1-2 phút rồi đun nóng.
Phản ứng dương tính khi trong ống nghiệm xuất hiện màu đỏ tươi hay đỏ da cam.
+ Phản ứng với dung dịch kiềm NaOH 10%:
Cho dung dịch mẫu vào 2 ống nghiệm: Ống 1 làm đối chứng, ống 2 thêm vài giọt NaOH 10%. Phản ứng dương tính khi trong ống nghiệm xuất hiện màu vàng đậm [13, 18].
2.2.1.3. Thử định tính Alcaloid
Mẫu thử được pha trong dung dịch axit sunfuric 2 – 5% với một lượng thích hợp để làm các phản ứng:
+ Phản ứng với thuốc thử Vans-Mayer (HgCl2 và KI trong nước):
Alcaloid cho kết tủa trắng hay vàng nhạt.
+ Phản ứng với thuốc thử Dragendorff (hỗn hợp Bi(NO3)3 và KI trong dung dịch axit acetic): Alcaloid cho kết tủa màu vàng cam đến đỏ [13, 21].
2.2.1.4. Thử định tính Tanin
+Phản ứng với vanilin: Cho vài giọt dịch mẫu vào 2 ống nghiệm: một ống làm đối chứng, ống 2 thêm vài giọt thuốc thử vanilin/H2SO4. Phản ứng dương tính khi thấy màu đỏ đậm.
+ Phản ứng với chì acetat: Cho vài giọt chì acetat 10% vào dung dịch mẫu. Phản ứng dương tính khi thấy xuất hiện kết tủa [13, 18].
2.2.1.5. Thử định tính glycozid
+ Phản ứng Keller-Killian:
Dung dịch A: 5ml CH3COOH 10% + 0.1ml FeCl3
Dung dịch B: một ít H2SO4 đ + 0.5ml FeCl3
Lấy 0,01g mẫu thử đã cô cạn cho vào ống nghiệm. Thêm 1ml dung
dịch A cho hòa tan hết mẫu, sau đó nghiêng ống nghiệm cho từ từ dung dịch
B vào, nếu xuất hiện màu nâu đỏ giữa hai lớp chất lỏng là dương tính [13, 18].
2.2.1.6. Thử định tính steroid
Hòa tan một lượng mẫu cần thiết trong dung dịch chloroform (00C).
Cho vào ống nghiệm 1ml anhydric acetic + 1ml chloroform (để ở 00C) trong vài phút, tiếp đến nhỏ vài giọt H2SO4 đặc. Cho mẫu đã hòa tan trong chloroform vào hỗn hợp trên, nếu xuất hiện màu xanh lục, hồng, da cam hoặc đỏ (màu bền vững) thì kết luận mẫu dương tính [13, 18].
2.2.2. Tạo mô hình chuột ĐTĐ type 2 trên chuột béo phì thực nghiệm
Chúng tôi tiến hành tạo mô hình ĐTĐ type 2 trên chuột gồm hai bước chính là:
+ Tạo chuột béo phì bằng chế độ dinh dưỡng giầu chất béo trong vòng 8 tuần.
+ Gây ĐTĐ type 2 bằng STZ trong vòng 10 ngày.
2.2.2.1. Gây béo phì
Chuột mua từ Viện Vệ sinh Dịch tễ Trung ương, được nuôi ở điều kiện bình thường. Chuột được cho ăn thức ăn tiêu chuẩn (do Viện Vệ sinh Dịch tễ Trung ương) trong 3-4 ngày để thích nghi với điều kiện môi trường mới sau đó được phân thành hai nhóm:
+ Nhóm 1 – nhóm đối chứng: 20 con, tiếp tục cho ăn thức ăn tiêu chuẩn (ND - Normal diet).
+ Nhóm 2 – nhóm béo phì: 100 con, cho ăn thức ăn giầu chất béo (30% chất béo, 20% protein, 40% cacbonhydrat, 5% vitamin và các muối khoáng) (HFD – High fat diet)
Chuột được nuôi trong vòng 8 tuần, sau đó tiến hành chọn lọc những con chuột đạt tiêu chuẩn để tiến hành thực hiện các nghiên cứu tiếp theo.
2.2.2.2. Gây ĐTĐ type 2 thực nghiệm bằng Streptozotocin Streptozotocin (STZ) là chất hóa học thuộc nhóm hợp chất glucosamine nitrosorea, có công thức hóa học là C8H15N3O7, tồn tại trong tự nhiên, có khả năng gây độc đặc hiệu với tế bào β sản xuất insulin của tuyến tụy ở động vật có vú. STZ được phát hiện có trong một chủng vi khuẩn có tên là
Streptomyces achromogenes vào những năm 50 của thế kỷ 20, hiện nay STZ đang được sử dụng trong y tế để điều trị một số ung thư trên đảo tụy Langerhan và là chất gây ĐTĐ hữu hiệu trên các mô hình động vật thực nghiệm, nhằm phục vụ cho các nghiên cứu y học [13, 32, 33].
Cơ chế gây độc: STZ nhận biết và xâm nhập vào các tế bào β qua kênh vận chuyển glucose GLUT2, alkyl hóa và làm tổn thương ADN, cuối cùng dẫn đến hoại tử tế bào. Hoạt tính alkyl hóa được cho là do hoạt động của nhóm nitrosourea, đặc biệt là vị trí O6 của guanine.
Tùy vào liều lượng STZ và cách thức tiến hành tiêm thuốc mà người ra có thể gây mô hình động vật ĐTĐ type 1 hay ĐTĐ type 2. Liều trên chuột nhắt dao động từ 100-150mg/kg, trên chuột cống dao động từ 40-100mg/kg [13, 32, 33].
Để tạo mô hình ĐTĐ type 2 thực nghiệm ở chuột, sau khi nuôi 8 tuần, các con chuột được nhịn đói khoảng 8h, tiến hành tiêm màng bụng STZ (pha trong đệm citrat 0.01M, pH = 4.3) một lần với liều 120mg/kg thể trọng. Phân lô cụ thể như sau:
Nhóm đối chứng:
- Lô 1: ND + đệm
- Lô 2: ND + STZ
Nhóm béo phì:
- Lô 3: HFD + đệm
- Lô 4: HFD + STZ
Sau khi tiến hành tiêm STZ, các con chuột vẫn được nuôi dưỡng theo chế độ dinh dưỡng ban đầu. Nồng độ glucose huyết được kiểm tra sau 0h, 48h, 72h, 5 ngày, 7 ngày, 8 ngày và 10 ngày tương ứng.
2.2.3. Phương pháp định lượng glucose huyết
Định lượng glucose huyết bằng kỹ thuật enzyme. Glucoseoxidase bị oxy hóa nhờ sự xúc tác của các enzyme có trên bề mặt của vùng phẩn ứng giấy thử và đọc kết quả trên máy One Touch Ultra do hãng Johnson & Johnson sản xuất [12, 20, 21].
2.2.3.1. Nguyên lý hoạt động
Khi máu tiếp xúc với bề mặt của vùng phản ứng que thử, glucose (trong máu) sẽ phản ứng với oxy (trong không khí) nhờ xúc tác của enzyme glucooxydase (có ở trên bề mặt vùng phản ứng của giấy thử) tạo acid gluconic và hydrogen peroxide. Hydrogen peroxide vừa tạo ra sẽ oxy hóa thuốc nhuộm trên bề mặt vùng phản ứng làm biến đổi màu của giấy thử vùng phản ứng (từ màu kem chuyển dần sang màu xanh). Độ đậm màu xanh tuỳ thuộc vào nồng độ glucose chứa trong mẫu máu.
Mỗi 1cm2 của vùng phản ứng trên giấy thử gồm các chất sau: glucose oxidase (14IU), peroxidase (11IU), 3- Methyl-2-benzothiazolinonehydrazone hydrochloride (0.06mg), và acid 3-Dimethyllaminnobenzoic (0.12mg). Các thành phần này đóng vai trò là các chất xúc tác phản ứng oxy hóa glucose và chất chỉ thị màu giúp nhận biết nồng độ glucose có trong mẫu máu nhờ hệ thống quang học của máy One Touch Ultra.
2.2.3.2. Phương pháp tiến hành
Máy One Touch Ultra đo lượng đường glucose trong máu toàn phần.
Máu được thấm vào đầu trên của que thử One Touch Ultra và tự động hút vào vùng đo nơi phản ứng xảy ra.
- Gắn một que thử để bật máy. Nhấn nút C để chọn mã số chính xác với mã ghi trên lọ que thử.
- Tạo vết cắt trên đuôi chuột, bỏ giọt máu đầu, lấy giọt máu thứ 2.
Mẫu máu dùng cho việc đo là 1µl, phải là một máu tròn đầy. Thấm nhẹ giọt máu vào điểm nhận máu trên đầu que thử. Sau 5 giây kết quả sẽ hiện thị trên màn hình.
2.2.4. Nghiên cứu khả năng hạ đường huyết của các phân đoạn dịch chiết
quả và củ chuốt hột lên chuột ĐTĐ type 2 thực nghiệm
Chuột bị ĐTĐ type 2 được tiến hành phân lô để nghiên cứu khả năng
hạ đường huyết khi xử lý với các dịch chiết khác nhau:
Lô 1: Nhóm đối chứng cho uống nước muối sinh lý 10ml/kg
Lô 2: Uống metfomin liều 500mg/kg
Lô 3: Uống dịch chiết nước tổng số quả chuối hột liều 500mg/kg
Lô 4: Uống dịch chiết phân đoạn n-hexan quả chuối hột liều 500mg/kg
Lô 5: Uống dịch chiết phân đoạn ethylacetat quả chuối hột liều 500mg/kg
Lô 6: Uống dịch chiết phân đoạn cồn 600
quả chuối hột liều 500mg/kg
Lô 7: Uống dịch chiết nước tổng số củ chuối hột liều 500mg/kg
Lô 8: Uống dịch chiết phân đoạn n-hexan củ chuối hột liều 500mg/kg
Lô 9: Uống dịch chiết phân đoạn ethylacetat củ chuối hột liều 500mg/kg
Lô 10: Uống dịch chiết phân đoạn cồn 600 củ chuối hột liều 500mg/kg
Chuột được uống thuốc vào 8h sáng hằng ngày và đo nồng độ glucose huyết vào các thời điểm: 0h (trước khi thí nghiệm), 2h, 4h, 8h, 3 ngày, 15 ngày.
Các số liệu được xử lý bằng thuật toán thống kê X. t-test student.
2.2.5. Phương pháp xác định hoạt tính chống oxi hóa của một số enzyme
2.2.5.1. Xác định hoạt độ enzyme catalase
Nguyên tắc
Catalase phân giải H2O2 thành H2O và O2, lượng H2O2 thừa được chuẩn độ bằng KMnO4 trong môi trường axit. Phản ứng tiến hành theo phương trình [11, 23]:
H2O2 H2O + O2
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 8H2O + 5O2
Máu chuột được lấy từ chuột ĐTĐ type 2 sau 10 ngày cho uống dịch chiết thực vật và pha loãng 1000 lần để thực hiện thí nghiệm.
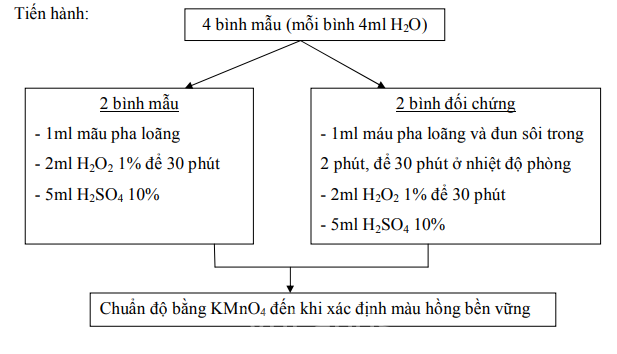
2.2.5.2. Xác định hoạt độ Cytocrome b5
Nguyên tắc: Cytocrome b5 trong mẫu thử được tiến hành định lượng theo phương pháp của Schenkman và cộng sự (1973). Dựa vào quang phổ hấp thụ phân biệt giữa trạng thái khử (bằng NADH) và trạng thái oxy hóa của Cytocrome b5 ở bước sóng 427nm để tính toán, sử dụng hệ số 427nm/500nm = 112 mM-1
cm-1 [11, 23].
Tiến hành: 0,5ml dịch thử được pha loãng với 5,5ml đệm 0,1M natri photphat pH 7,4. Chia hỗn hợp vào 2 ống, ống thử cho thêm NADH, sau 10 phút để ở nhiệt độ phòng, mẫu được đo quang phổ ở bước song 427nm và 500nm.
Cách tính hàm lượng Cytocrome b5: Ccytb5 (mM/ml) = (E427 - E500)x độ pha loãng/
Trong đó:
E427, E500: Chênh lệch giữa độ hấp thụ của mẫu thử và mẫu chứng ở bước sóng 427nm và 500nm.
: 427nm/500nm = 112 mM-1 cm-1
Hàm lượng đặc hiệu Cytocrome b5 (mM/mg protein) = Ccyt-b5/HL protein.
2.2.5.3. Xác định chỉ số GOT và GPT
GOT (SGOT, AST) là một loại transaminaza aspartat aminotransferaza. GPT (SGPT, ALT) là alanin aminotransferaza. Chúng xúc tác cho hai phản ứng [11, 23]:
Aspartat + Alpha-ketoglutarat GOT
Glutamat + Oxalo axetat
Alanin + Alpha-ketoglutarat GPT
Glutamat + Pyruvat
Đây là 2 enzyme được coi như liên quan đến sự tổn thương hoặc viêm nhiễm ở gan, mặc dù người ta không chỉ phát hiện nó ở gan mà còn ở nhiều cơ quan khác như thận, tim. Khi gan bị tổn thương, nồng độ các enzyme này thường tăng cao, chỉ khi hết tổn thương thì nó mới trở lại bình thường.
Hai enzyme được phân tích tại Phòng Hóa sinh của Bệnh viện Medlatec.
2.2.6. Phương pháp phân lập các hợp chất
2.2.6.1. Sắc ký lớp mỏng (TLC)
Sắc ký lớp mỏng được thực hiện trên bản mỏng tráng sẵn DCAlufolien 60 F254 (Merck 1,05715), RP18 F254s (Merck). Phát hiện chất bằng đèn tử ngoại ở hai bước sóng 254nm và 368nm hoặc dùng thuốc thử là dung dịch H2SO4 10% được phun đều lên bản mỏng, sấy khô rồi hơ nóng trên bếp điện từ từ đến khi hiện màu [13].
2.2.6.2. Sắc ký lớp mỏng điều chế
Sắc ký lớp mỏng điều chế thực hiện trên bản mỏng tráng sẵn Silica gel 60G F254 (Merck, ký hiệu 105875), phát hiện vệt chất bằng đèn tử ngoại hai bước sóng 254nm và 368nm, hoặc cắt rìa bản mỏng để phun thuốc thử là dung dịch H2SO4 10%, hơ nóng để phát hiện vệt chất, ghép lại bản mỏng như cũ để xác định vùng chất, sau đó cạo lớp Silica gel có chất, giải hấp phụ bằng dung môi thích hợp [13].
2.2.6.3. Sắc ký cột (CC)
Sắc ký cột được tiến hành với chất hấp phụ là Silica gel pha thường và pha đảo. Silica gel pha thường có cỡ hạt là 0,040-0,063mm (240-430 mesh).
Silica gel pha đảo ODS hoặc YMC (30-50µm, FuJisilica Chemical Ltd.) [13].
2.2.7. Các phương pháp xác định cấu trúc của các hợp chất hữu cơ
Cấu trúc hóa học của các hợp chất hữu cơ được xác định nhờ vào các phương pháp phổ kết hợp. Tùy thuộc vào cấu trúc hóa học của từng hợp chất mà người ta sử dụng những phương pháp phổ cụ thể. Cấu trúc càng phức tạp thì yêu cầu phối hợp các phương pháp phổ càng cao. Trong một số trường hợp, để xác định chính xác cấu trúc hóa học của các hợp chất người ta còn phải dựa vào các phương pháp bổ sung khác như chuyển hóa hóa học, kết hợp với các phương pháp sắc ký so sánh [13].
2.2.7.1. Điểm nóng chảy (Mp)
Điểm nóng chảy được đo trên máy Kofler micro-hotstage của Viện Hóa học các hợp chất thiên nhiên.
2.2.7.2. Kỹ thuật phổ khối lượng (Mass Spectroscopy)
Kỹ thuật phổ khối lượng được sử dụng khá phổ biển để xác định cấu trúc hóa học của các hợp chất hữu cơ. Nguyên tắc chủ yếu của phương pháp phổ này là dựa vào sự phân mảnh ion của các phân tử chất dưới sự bắn phá của chùm ion bên ngoài. Ngoài ion phân tử, phổ MS còn cho các píc ion mảnh khác mà dựa vào đó người ta có thể xác định được cơ chế phân mảnh và dựng lại được cấu trúc hóa học các hợp chất. Hiện nay có rất nhiều loại kỹ thuật phổ khối lượng. Những phương pháp chủ yếu được nêu ra dưới dây:
+ Kỹ thuật phổ EI-MS (Electron Impact Ionization Mass Spectroscopy) dựa vào sự phân mảnh ion dưới tác dụng của chùm ion bắn phá với năng lượng khác nhau, phổ biến là 70eV.
+ Kỹ thuật ESI-MS (Electron Spray Ionization Mass Spectroscopy) gọi là phổ phun mù điện tử. Phổ này được thực hiện với năng lượng bắn phá thấp hơn nhiều so với phổ EI-MS, do đó phổ thu được chủ yếu là píc ion phân tử và các píc đặc trưng cho sự phá vỡ các liên kết có mức năng lượng thấp, dẽ bị phá vỡ.
+ Kỹ thuật phổ FAB-MS (Fast Atom Bombardmen Mass Spectroscopy) là phổ bắn phá nguyên tử nhanh với sự bắn phá nguyên tử nhanh ở năng lượng thấp, do đó phổ thu được cũng dẽ thu được píc ion phân tử.
+ Kỹ thuật phổ khối lượng phân giải cao (High Resolution Mass Spectroscopy), cho phép xác định píc ion phân tử hoặc ion mảnh với độ chính xác cao. Kết quả phổ khối lượng phân giải cao cùng với kết quả phân tích nguyên tố sẽ cho phép khẳng định chính xác công thức cộng của hợp chất hữu cơ.
+ Ngoài ra, hiện nay người ta còn sử dụng kết hợp các phương pháp sắc ký kết hợp với khối phổ. Phương pháp này đặc biệt hiệu quả khi sử dụng thư viện phổ để so sánh nhận dạng các hợp chất. Có thể sử dụng GC-MS (sắc ký
khí khối phổ) cho các hợp chất dễ bay hơi như tinh dầu, hay LC-MS (sắc ký lỏng-khối phổ) cho các hợp chất khác. Các phương pháp kết hợp này còn đặc biệt hữu hiệu khi phân tích thành phần của hỗn hợp chất (nhất là phân tích thuốc trong ngành dược).
2.2.7.3. Kỹ thuật phổ cộng hưởng từ hạt nhân (Nuclear Magnetic Resonance Spectroscopy, NMR)
Phổ cộng hưởng từ hạt nhân là một phương pháp phổ hiện đại và hữu hiệu nhất hiện nay được dùng để xác định cấu trúc hóa học của các hợp chất hữu cơ nói chung và hợp chất thiên nhiên nói riêng. Với việc sử dụng kết hợp các kỹ thuật phổ NMR một chiều và hai chiều, các nhà nghiên cứu có thể xác định chính xác cấu trúc của hợp chất, kể cả cấu trúc lập thể của phân tử.
Nguyên lý chung của các phương pháp phổ NMR (phổ proton và cabon) là sự cộng hưởng khác nhau của các hạt nhân từ (1H và 13C) dưới tác dụng của từ trường ngoài. Sự cộng hưởng khác nhau này được biểu diễn bằng độ dịch chuyển hóa học (chemical shift). Ngoài ra, đặc trưng của phân tử còn được xác định dựa vào tương tác spin giữa các hạt nhân từ với nhau (spin coupling).
a-Phổ 1 H-NMR
Trong phổ 1 H-NMR, độ dịch chuyển hóa học () của các proton được xác định trong thang ppm từ 0 ppm đến 14ppm tùy thuộc vào mức độ lai hóa của nguyên tử cũng như đặc trưng riêng của từng phân tử. Mỗi loại proton cộng hưởng ở một trường khác nhau và vì vậy chúng được biểu diễn bằng một độ dịch chuyển hóa học khác nhau. Dựa vào những đặc trưng của độ dịch chuyển hóa học cũng như tương tác spin coupling mà người ta có thể xác định được cấu trúc hóa học của hợp chất.
b-Phổ 13C-NMR
Phổ này cho tín hiệu vạch phổ của cacbon. Mỗi nguyên tử cacbon sẽ cộng hưởng ở một trường khác nhau và cho một tín hiệu phổ khác nhau.
Thang đo cho phổ 13C-NMR cũng được tính bằng ppm và với dải thang đo rộng hơn so với phổ proton (từ 0 ppm đến 240 ppm).
c-Phổ DEPT (Distortionless Enhancement by Polarisation Transfer)
Phổ này cho ta những tín hiệu phổ phân loại các loại cacbon khác nhau.
Trên các phổ DEPT, tín hiệu của cacbon bậc bốn biến mất. Tín hiệu phổ của CH và CH3 nằm về một phía và của CH2 về một phía trên phổ DEPT 135o
.
Còn trên phổ DEPT 90o thì chỉ xuất hiện tín hiệu phổ của các CH.
d-Phổ 2D-NMR
Đây là các kỹ thuật phổ hai chiều, cho phép xác định các tương tác của các hạt nhân từ của phân tử trong không gian hai chiều. Một số kỹ thuật chủ yếu thường được sử dụng như sau:
+ Phổ HMQC (Heteronuclear Multiple Quantum Coherence)
Các tương tác trực tiếp H-C được xác định nhờ vào các tương tác trên phổ này. Trên phổ, một trục là phổ 1
H-NMR còn trục kia là 13C-NMR. Các tương tác HMQC nằm trên đỉnh các ô vuông trên phổ.
+ Phổ 1
H1
H COSY (HOMOCOSY) 1
H1
H Chemical Shift Corelation
Spectroscopy
Phổ này biểu diễn các tương tác H-H, chủ yếu của các proton đính với cacbon liền kề nhau. Chính nhờ phổ này mà các phần của phân tử được nối ghép lại với nhau.
+ Phổ HMBC (Heteronuclear Multiple Bond Connectivity) Đây là phổ biểu diễn các tương tác xa của H và C trong phân tử. Nhờ vào các tương tác trên phổ này mà từng phần của phân tử cũng như toàn bộ phân tử được xác định về cấu trúc.
+ Phổ NOESY (Nucler Overhauser Effect Spectroscopy)
Phổ này biểu diễn các tương tác xa trong không gian của các proton không kể đến các liên kết mà chỉ tính đến khoảng cách nhất định trong không gian. Dựa vào kết quả phổ này, có thể xác định được cấu trúc không gian của phân tử.
Người ta còn sử dụng hiệu ứng NOE bằng kỹ thuật phổ NOE
defferences để xác định cấu trúc không gian của phân tử. Bằng việc đưa vào một xung đúng bằng từ trường cộng hưởng của một proton xác định thì các proton có cùng phía về không gian cũng như gần nhau về mặt không gian sẽ cộng hưởng mạnh hơn và cho tín hiệu phổ với cường độ mạnh hơn.
Ngoài ra, ngày nay người ta còn sử dụng nhiều kỹ thuật phổ hai chiều rất hiện đại khác, ví dụ như kỹ thuật xóa tương tác trên các phổ nhất định (decoupling), ví dụ như trên phổ proton, xóa tương tác của một proton nào đó xác định có thể xác định được vị trí của các proton bên cạnh …
Ngoài các phương pháp phổ nêu trên, trên thế giới, người ta còn sử dụng phổ X-RAY (nhiễu xạ Rơngen) để xác định cấu trúc không gian của toàn bộ phân tử. Tuy nhiên phạm vi sử dụng của phổ này rất hạn chế, bởi vì yêu cầu tiên quyết là cần phải có đơn tinh thể. Đây là một điều kiện không phổ biến đối với các hợp chất hữu cơ.
Như trên đã đề cập, ngoài việc sử dụng các loại phổ, người ta còn phải sử dụng kết hợp với các chuyển hóa học cũng như các phương pháp phân tích so sánh kết hợp. Đặc biệt đối với các phân tử nhiều mạnh nhánh dài, tín hiệu
phổ NMR bị chồng lấp nhiều khó xác định chính xác được chiều dài các mạch, cũng như đối với các phân tử có các đơn vị đường thì việc xác định chính xác loại đường cũng như cấu hình đường thông thường phải sử dụng phương pháp thủy phân rồi xác định bằng phương pháp so sánh bằng LC-MS hoặc GC-MS với các đường chuẩn dự kiến [13].
Chương 3. KẾT QUẢ VÀ THẢO LUẬN
3.1. Kết quả tách chiết mẫu
3.1.1. Chiết nước nóng
Quả và củ chuối hột sau khi được thu hái, rửa sạch, sấy khô ở nhiệt độ 60 C và tán nhỏ. Lấy 300g mẫu cho nước vào với tỉ lệ 1:7; 1:5; 1:3 đun cách thủy 3 lần ở nhiệt độ 90C, thu dịch lọc đem cô quay chân không thu được cao nước nóng.
3.1.2. Chiết phân đoạn bằng hệ dung môi
Lấy 3kg mẫu ngâm trong dung môi n-hexan nhiều lần cho đến khi dịch lọc hết màu, sấy khô bã lọc đã ngâm n-hexan đem ngâm tiếp trong dung môi ethylacetat cho đến khi dịch lọc không còn màu, rồi lại sấy khô và ngâm trong cồn 60 cho đến khi dịch lọc hết màu. Các dịch lọc được cô quay chân không thu được cao n-hexan, cao ethylacetat và cao cồn. Hiệu suất chiết rút được thể hiện trong bảng 1 và bảng 2:
Bảng 1. Kết quả tách chiết mẫu quả chuối hột
| Cao chiết | Khối lượng (g) | % tách chiết |
| Cao nước nóng | 102.9 | 34.3 |
| Cao n-hexan | 276.0 | 9.2 |
| Cao ethylacetat | 249 | 8.3 |
| Cao cồn | 402 | 13.4 |
Bảng 2: Kết quả tách chiết mẫu củ chuối hột
| Cao chiết | Khối lượng (g) | % tách chiết |
| Cao nước nóng | 138.6 | 46.2 |
| Cao n-hexan | 222.0 | 7.4 |
| Cao ethylacetat | 159 | 5.3 |
| Cao cồn | 663 | 22.1 |
Qua bảng 1 và bảng 2 ta thấy đối với cả hai mẫu quả và củ chuối hột, phương pháp chiết rút bằng nước nóng thu được nhiều cao nhất so với các phương pháp chiết rút bằng dung môi. Trong ba dung môi sử dụng chiết phân đoạn thì cồn ethanol 600 có hiệu suất chiết rút cao nhất, hai dung môi còn lại là n-hexan và ethylacetat có hiệt suất chiết rút kém hơn.
Sau khi chiết rút chúng tôi tiến hành khảo sát sơ bộ thành phần hóa học của dịch chiết quả và củ chuối hột.
3.2. Khảo sát sơ bộ thành phần hóa học của dịch chiết quả và củ chuối hột
Nhằm xác định sơ bộ thành phần hóa học của dịch chiết các bộ phận quả và củ chuối hột, chúng tôi tiến hành thử định tính các nhóm chất bằng các phản ứng đặc trưng như đã trình bày chi tiết ở phần phương pháp nghiên cứu, bước đầu thu được kết quả trong bảng 2:
Bảng 3. Kết quả thử định tính một số hợp chất tự nhiêncủa dịch chiết các bộ phận cây chuối hột
Người gửi / điện thoại
Đánh giá

- © Bản quyền thuộc về Vulands.com
